血流感染引发的败血症是临床上最严重的感染性疾病之一,荚膜细菌是血流感染最常见的病原体,包括革兰氏阳性菌肺炎链球菌、金黄色葡萄球菌和革兰氏阴性菌肺炎克雷伯菌、大肠埃希菌等。病原菌与宿主免疫系统的相互作用在血流感染过程中起着决定性作用,直接影响疾病进展和结局。肝脏和脾脏是人体两大血流过滤器,时刻监视着病原菌向血流中的侵袭感染。临床研究显示,脾脏功能缺陷的个体对荚膜细菌引发的血流感染尤为敏感,病死率高达50-70%。然而,脾脏发挥抗感染功能的细胞和分子机制仍不明确。
2025年3月12日,清华大学基础医学院张敬仁课题组与自动化系戴琼海课题组以及北京大学医学部安浩然课题组合作,揭示了脾脏红髓巨噬细胞(red pulp macrophage, RPM)清除血液中肺炎链球菌的关键免疫功能,并阐明了不同组织驻留巨噬细胞(tissue-resident macrophage, TRM)在抗感染免疫中的协作机制。该研究成果以“Splenic red pulp macrophages eliminate the liver-resistant Streptococcus pneumoniae from the blood circulation of mice”为题发表在Science Advances。

本研究选用低毒力(low virulence, LV)和高毒力(high virulence, HV)两种肺炎链球菌建立小鼠血流感染模型,发现在脾脏摘除小鼠中,即便极低剂量(103 CFU)感染HV菌株也能快速导致宿主死亡。团队先前研究发现肝脏是清除LV细菌的主要场所(An et al., J Exp Med, 2022; Huang et al., PLoS Pathog, 2022),因此脾脏缺失并不影响宿主对LV菌株的抵抗力(图一)。
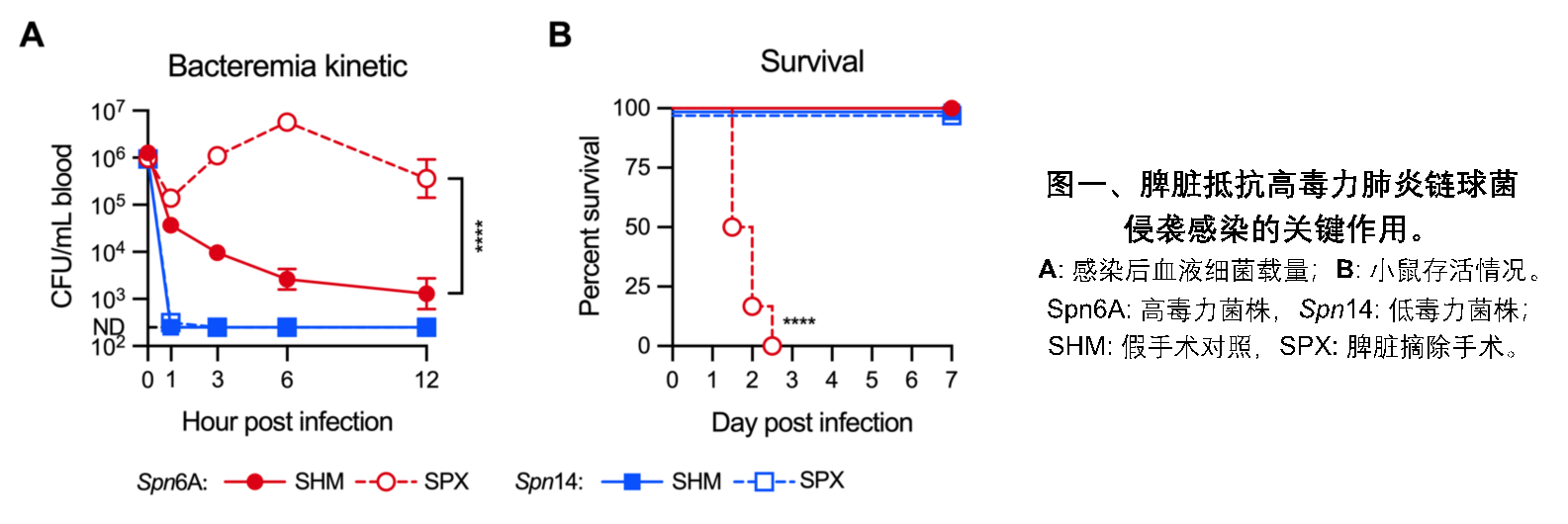
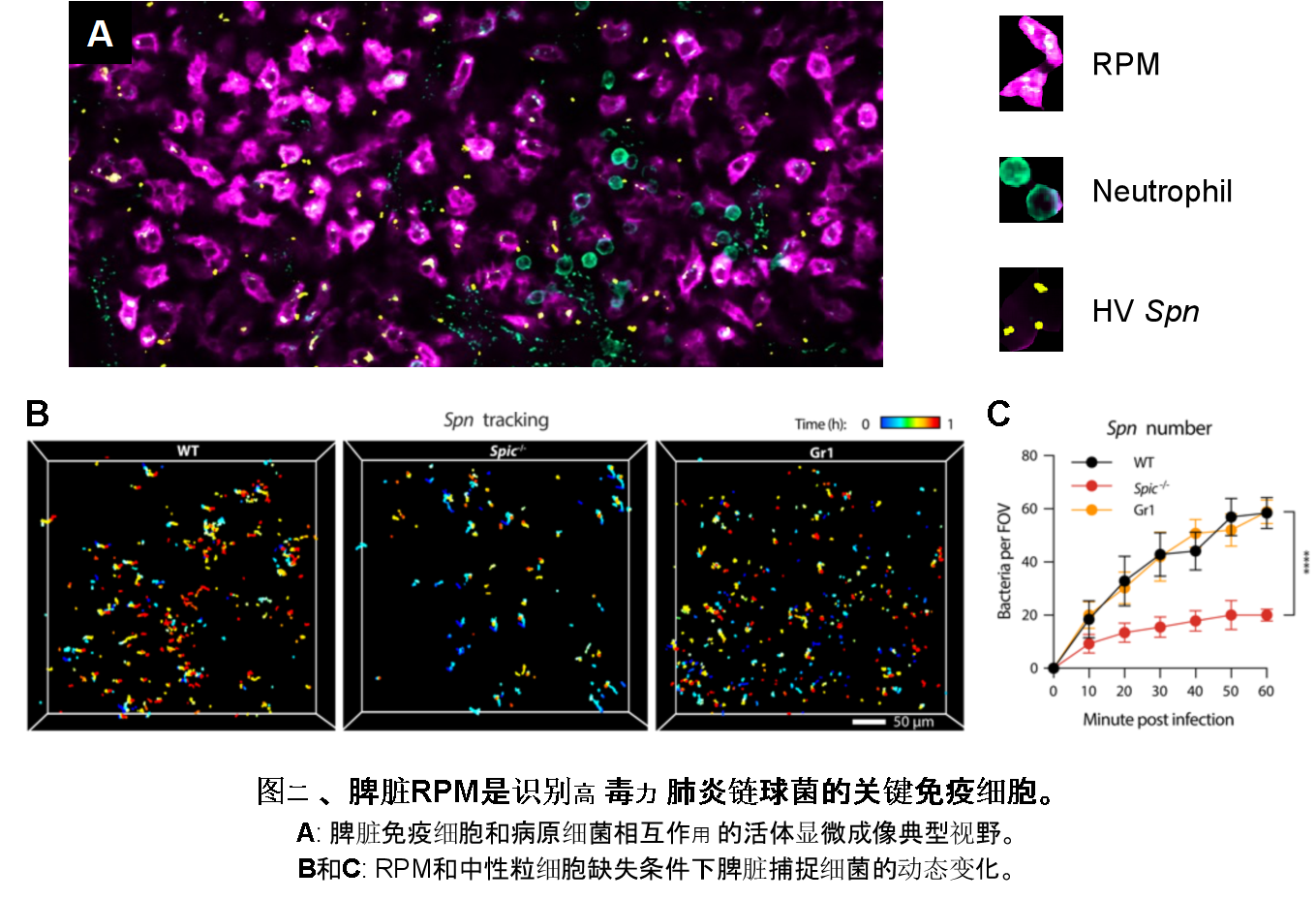
随后利用药物处理手段和基因敲除小鼠模型,团队证实了脾脏驻留巨噬细胞RPM是控制HV肺炎链球菌侵袭感染的核心免疫细胞,而中性粒细胞则扮演辅助作用。为了直观反映脾脏中免疫细胞和病原细菌的相互作用,研究团队利用自主研发的双光子合成孔径显微成像技术(2pSAM),在活体状态下进行长达4小时的原位实时监测,结果显示,血流中的细菌迅速进入脾脏,绝大部分被红髓区域的RPM捕获,少部分被中性粒细胞吞噬(图二)。
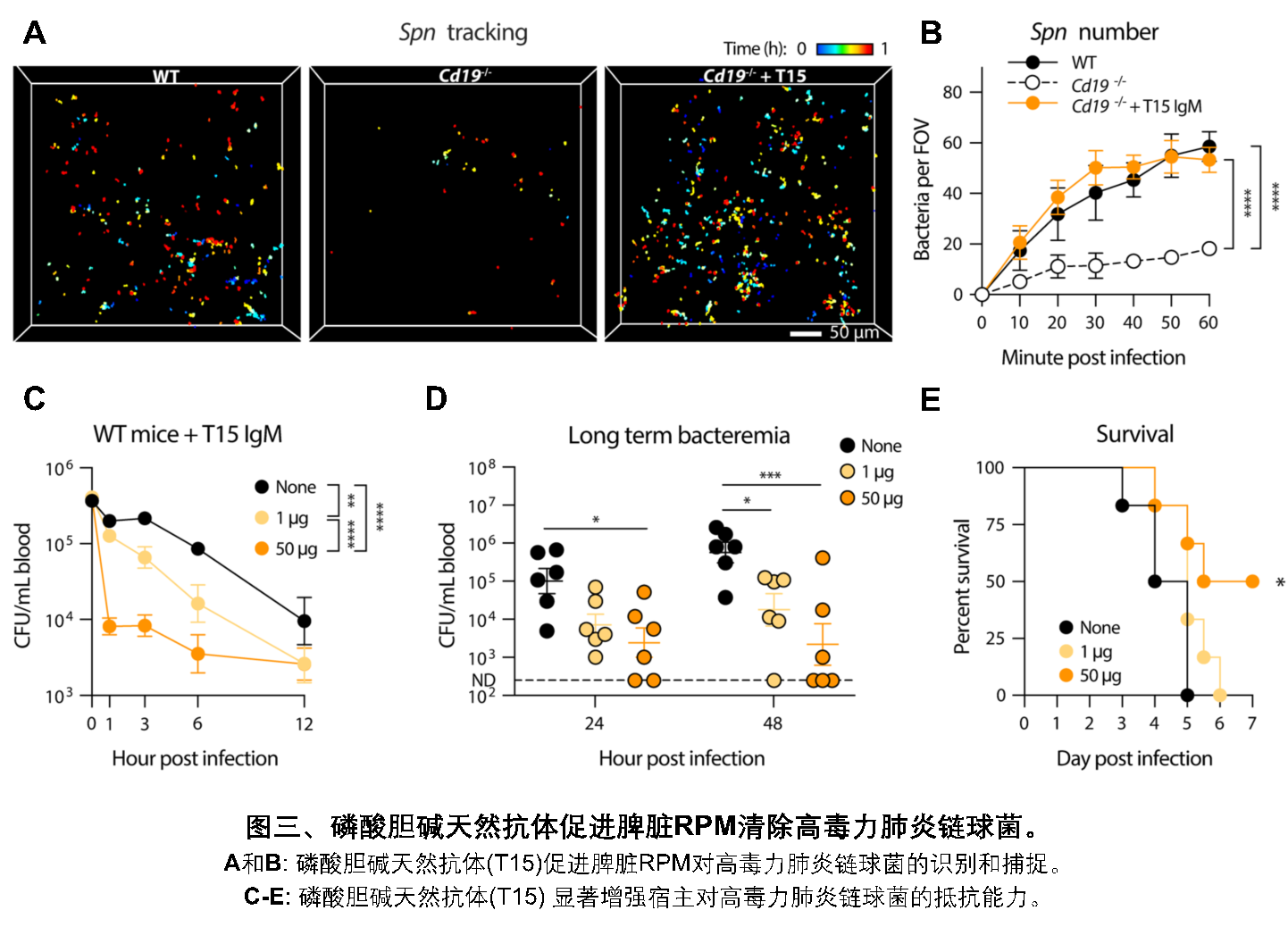
脾脏RPM如何识别肺炎链球菌呢?进一步研究发现,宿主血清中的天然抗体在脾脏清除HV菌株过程中是必不可少的效应分子。经过特异性竞争实验,团队鉴定了天然抗体靶向肺炎链球菌表面的磷酸胆碱(phosphocholine, PC)抗原,并利用重组表达的PC单克隆抗体(T15 IgM)证实了这一重要功能(图三)。此外,团队还发现血清中的补体系统是天然抗体下游的关键效应途径,从而揭示了天然抗体和补体这两大天然免疫因子在抗细菌免疫中的协同功能。
团队此前发现,肝脏巨噬细胞——枯否细胞(Kupffer cell, KC)是清除血流感染LV细菌的主要免疫细胞,而HV细菌能够逃脱KC的识别。本研究则揭示了逃逸KC免疫监视的HV细菌是如何被脾脏RPM清除的。值得注意的是,在KC功能缺陷(如重度肝病)模型中,LV细菌的免疫清除同样依赖脾脏RPM的“后援”。由此可见,在系统性感染疾病中,宿主不同器官的驻留巨噬细胞具有精细的分工,共同维持机体的免疫防御功能(图四)。
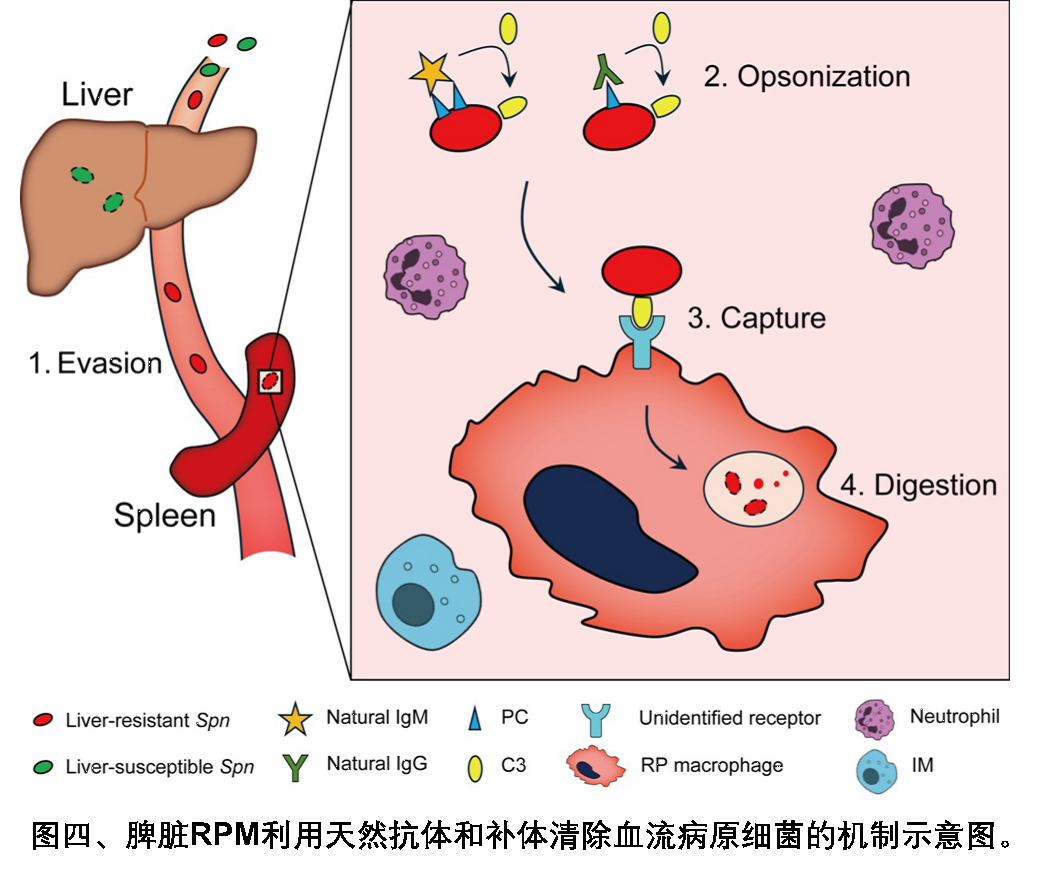
综上,这项研究揭示了脾脏RPM依赖天然抗体和补体清除高侵袭性肺炎链球菌的免疫机制,解答了临床上脾脏缺陷或摘除个体为何对病原细菌更易感染的问题,为深入理解宿主抵御病原细菌感染的免疫功能提供了新的科学视角。
清华大学基础医学院已出站博士后安浩然(现已入职北京大学医学部)、清华大学基础医学院毕业生黄益嘉博士(现已入职温州医科大学)和自动化系赵志锋为论文的共同第一作者。该研究获得了国家重点研发计划和国家自然科学基金的共同资助。
原文链接:https://doi.org/10.1126/sciadv.adq6399