近年来,mRNA技术在肿瘤免疫治疗领域展现出巨大潜力。然而,现有的 mRNA-LNP 癌症疫苗研究多聚焦在增强抗原表达与免疫原性,其在诱导高质量肿瘤特异性CD8+ T细胞方面仍显不足。研究表明,目前LNP递送体系主要诱导IL-1β、IL-6和IFN-I等细胞因子,从而增强抗原特异性CD4⁺滤泡辅助性T细胞(Tfh)和B细胞反应。然而,IL-6等细胞因子可能抑制初始T细胞向效应T细胞的分化,而后者对于有效的抗肿瘤免疫应答至关重要。因此,选择合适的佐剂是提升mRNA肿瘤疫苗疗效与安全性的关键。
2025年6月6日,清华大学基础医学院傅阳心/梁永团队在 Journal of Experimental Medicine 在线发表了题为“Membrane-IL12 adjuvant mRNA vaccine polarizes pre-effector T cells for optimized tumor control”的研究成果。该研究开发了编码膜型IL12(mtIL12)佐剂的新一代mRNA-LNP疫苗。该设计将mtIL12限制性表达在抗原呈递细胞表面,在诱导强效肿瘤特异性T细胞应答的同时,有效规避了传统IL-12带来的全身性副作用。该研究与宾夕法尼亚大学诺贝尔团队Christopher A. Hunter、Drew Weissman通讯在《Science immunology》发表的论文“An IL12 mRNA-LNP adjuvant enhances mRNA vaccine–induced CD8 T cell responses”同日在线,提示了基于细胞因子的新型mRNA-LNP疫苗的重大潜力。

为筛选能增强mRNA疫苗诱导CD8+ T细胞反应的细胞因子,研究团队测试了多种作用于CD8+ T细胞的强效因子,最终确定IL-12可显著提升mRNA疫苗的抗肿瘤免疫反应。团队首先构建了共表达分泌型游离IL12(sIL12)和肿瘤抗原的mRNA,证实加入sIL12编码序列确实能显著提升抗肿瘤效果,但也同时大幅增加了疫苗的全身毒性,引发小鼠体重下降和全身性炎症因子风暴。
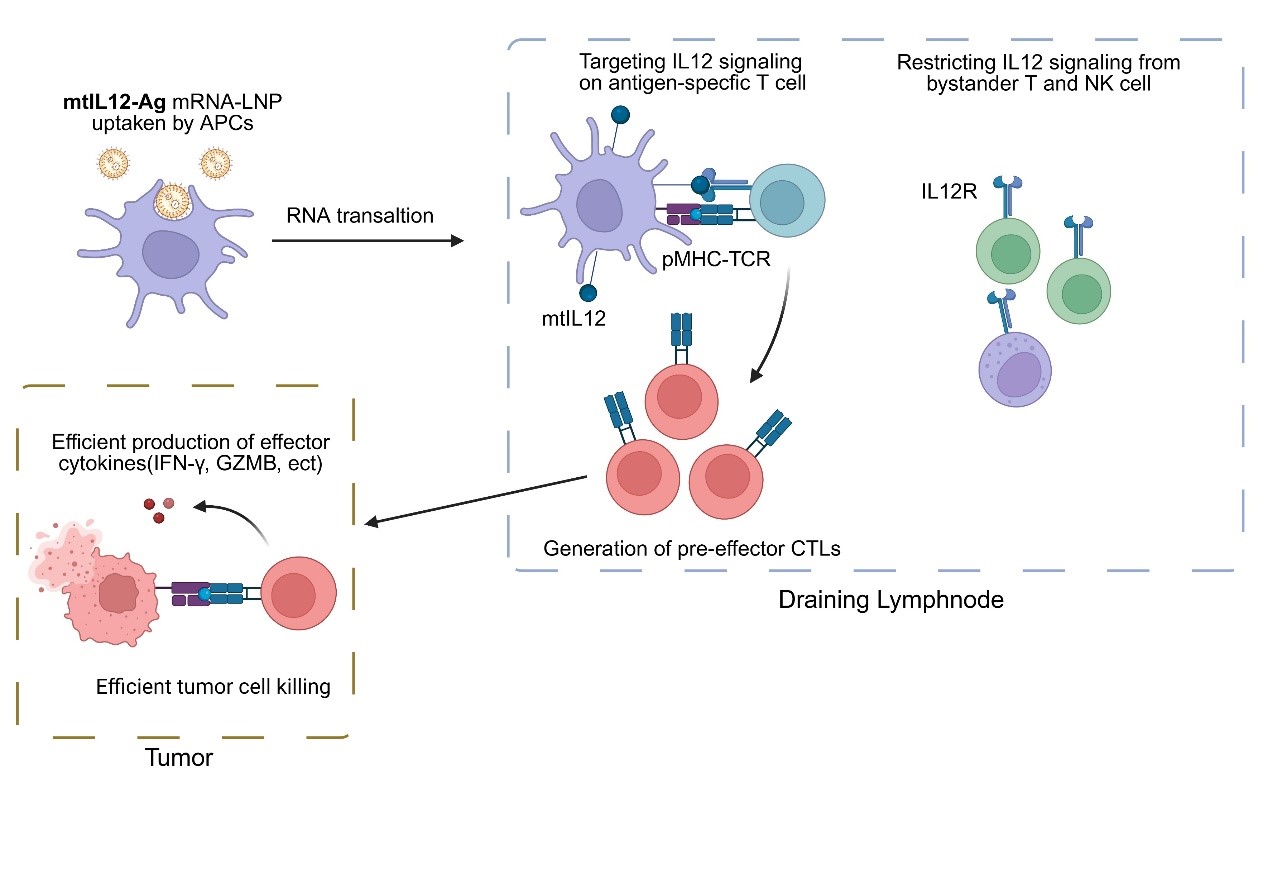
为进一步提高IL12作为佐剂的安全性,团队对IL12编码序列进行改造,在其C端连接跨膜结构域,成功将IL12锚定于被mRNA转染的抗原呈递细胞表面。这种膜型IL12(mtIL12)设计显著降低了IL12的外周毒性,同时维持了与分泌型IL12 mRNA分子同等强力的抗肿瘤效力。由此,整合mtIL12编码序列的mRNA成为一种高效且低毒性的mRNA疫苗新策略。
研究团队深入探索了mtIL12疫苗的作用机制。通过细胞删除实验,证实其抗肿瘤作用主要依赖于CD8+ T细胞。进一步对免疫后淋巴结中抗原特异性T细胞进行scRNA-seq+scTCR-seq测序分析,发现注射mtIL12疫苗的引流淋巴结内产生了一群独特的前效应T细胞(pre-effector T cell)。TCR克隆配对和拟时序分析(Pseudotime analysis)显示,这群细胞是产生外迁性效应T细胞的源泉。这些效应T细胞高表达向肿瘤趋化的受体以及杀伤性效应分子。流式细胞分析证实,mtIL12疫苗诱导的抗原特异性T细胞在淋巴结和外周血中,相比传统mRNA疫苗诱导的细胞展现出更强的效应分化特征,并且在肿瘤抗原再刺激后能产生更强的细胞毒性反应。
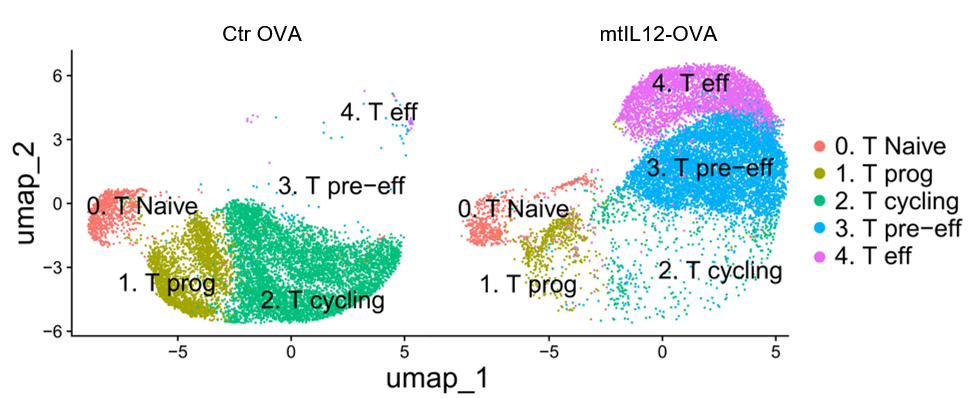
相较于常用的模式抗原,肿瘤内源性抗原更能代表临床肿瘤疫苗的靶点。团队进一步利用HPV抗原、肿瘤逆转录病毒来源抗原及肿瘤新抗原等靶点,在多种肿瘤模型中评估mtIL12佐剂mRNA疫苗的抗肿瘤效力。在所有测试模型中,添加mtIL12佐剂均能产生更强大的抗肿瘤效果,并在外周诱导出效应功能更强的抗原特异性T细胞。
该研究的核心创新点在于:确立了IL12是增强肿瘤mRNA疫苗疗效的有效因子,并通过创新性设计膜型IL12(mtIL12)作为mRNA疫苗佐剂,显著增强了传统mRNA疫苗的抗肿瘤效应,同时大幅降低了IL12的系统毒性。研究还首次揭示,mtIL12的加入会促使引流淋巴结中形成一群独特的前效应T细胞(pre-effector T cell),这群细胞分化产生的效应细胞具有更强的肿瘤杀伤能力。该成果不仅为优化mRNA肿瘤疫苗提供了新思路,更在多种肿瘤模型及临床相关肿瘤抗原靶点中验证了设计的有效性,展现出重要的临床转化价值。
该研究的通讯作者为清华大学基础医学院傅阳心教授和梁永副研究员,研究得到了分子肿瘤学全国重点实验室和昌平实验室的支持。清华大学基础医学院傅阳心课题组博士生彭琨为本文第一作者,傅阳心课题组博士生赵晓雪及林欣课题组博士生李泓健为研究提供了重要帮助。
原文链接:
https://doi.org/10.1084/jem.20241454
https://www.science.org/doi/10.1126/sciimmunol.ads1328