mRNA疫苗在传染病防控和肿瘤免疫治疗中展现出巨大潜力,但其递送依赖的传统PEG修饰脂质纳米粒(PEG-LNP)存在肝脏富集、免疫原性强和安全性风险等问题,严重限制了疫苗的疗效与应用范围。优化mRNA疫苗在体内的分布特性是开发新一代mRNA疫苗的关键方向之一。淋巴结是诱导免疫应答的关键部位,高效靶向淋巴系统的递送策略对于提升疫苗免疫效力和安全性至关重要。然而,目前尚缺乏既能避免肝毒性又具淋巴倾向性的mRNA递送系统。
2025年8月1日,清华大学化学系喻国灿教授团队、基础医学院程功教授团队与新加坡国立大学陈小元教授团队在《自然 材料》发表题为Albumin-recruiting lipid nanoparticle potentiates the safety and efficacy of mRNA vaccines by avoiding liver accumulation(白蛋白诱导脂质纳米粒子通过避免肝脏积聚提高 mRNA 疫苗的安全性和有效性)的研究成果。本研究提出并验证了一种新型白蛋白招募型脂质纳米颗粒(albumin-binding lipid nanoparticle, EB-LNP)递送系统,旨在提升mRNA疫苗的安全性与免疫效果。作者基于白蛋白在淋巴液中的高浓度与其向淋巴引流的天然特性,构建了多个具有白蛋白结合能力的离子化脂质,筛选出以Evans Blue修饰脂质(EB-lipid)为核心的EB-LNP体系,能高效吸附白蛋白并通过淋巴管靶向引流至淋巴结,并能够促进树突状细胞(DCs)的内吞并减少在肝脏的蓄积。实验证实,该体系在小鼠、兔、迷你猪等多种动物模型中相较PEG-LNP表现出显著的淋巴富集性、低肝分布、高树突状细胞摄取率,并激发更强的细胞与体液免疫反应。
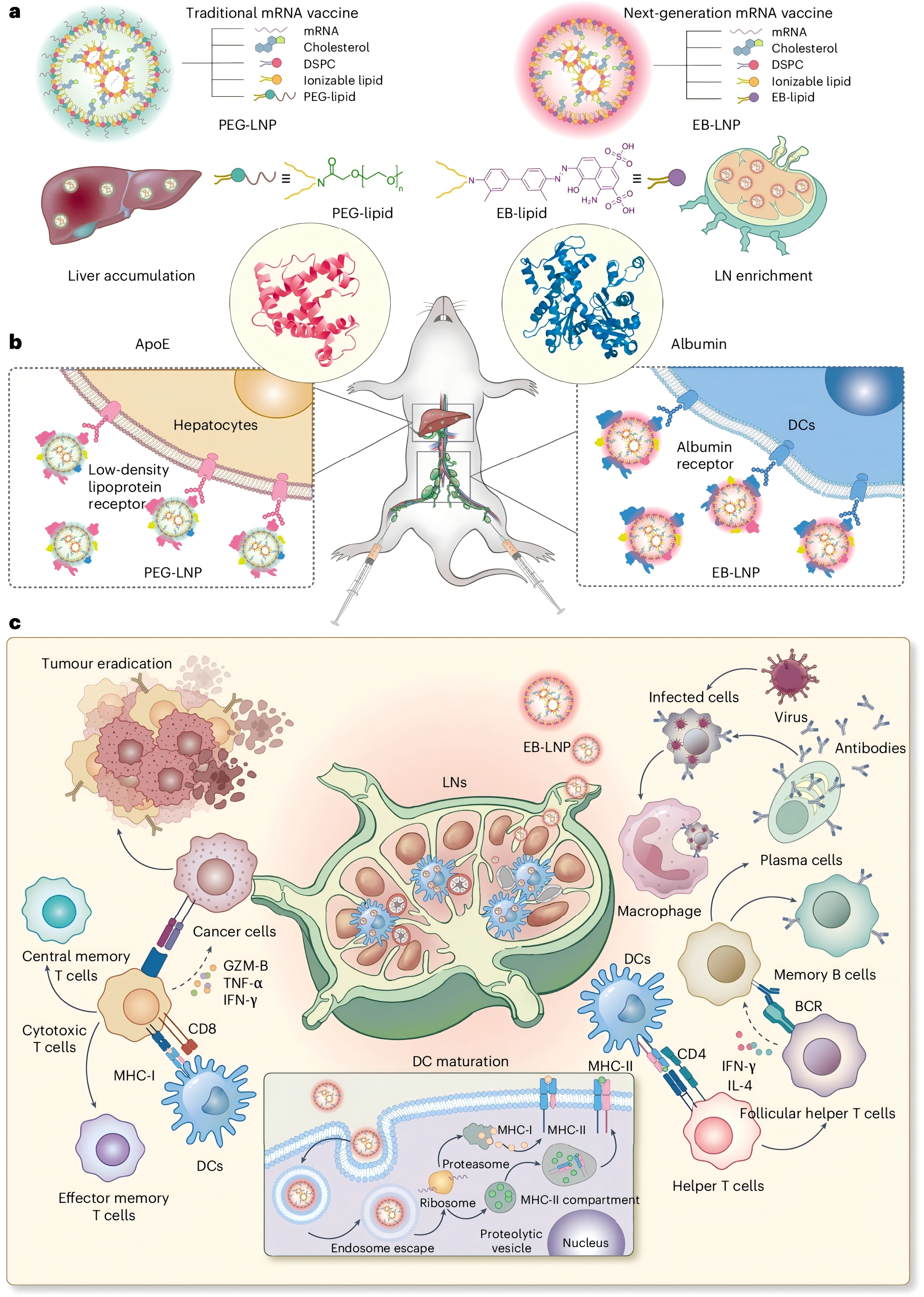
所设计的LNP递送系统的作用机制示意图
安全评估方面,多次注射EB-LNP的小鼠未出现明显的肝脏功能异常。相比之下,PEG-LNP导致肝功能指标显著升高,显示出潜在的肝脏毒性。此外,EB-LNP未诱导产生针对PEG的特异性抗体,表现出低免疫原性和良好的生物安全性。功能验证方面,EB-LNP包装的mRNA疫苗(EB-Vax)在多种疾病模型中展现出卓越的免疫保护效果。在B16-OVA黑色素瘤和HPV相关肿瘤模型中,EB-Vax能够强效激活细胞毒性T细胞(CTLs)和记忆性T细胞,促进肿瘤细胞杀伤。在流感和新冠病毒模型中,即便在低剂量下也诱导出高滴度的中和抗体反应。进一步机制研究表明,能够激发持久的B细胞免疫反应,EB-LNP通过与白蛋白结合形成独特的蛋白冠层,增强了其通过白蛋白受体(如gp60)介导的树突细胞内吞能力,并偏向淋巴系统转运而非血液系统,有效规避肝脏聚集。该研究为mRNA疫苗递送体系的安全性提升与靶向优化提供了新策略,具有广泛的应用前景。
该研究由清华大学、新加坡国立大学和深圳湾实验室等单位共同完成。清华大学化学系喻国灿教授、新加坡国立大学理学院陈小元教授、清华大学基础医学院程功教授为共同通讯作者。该研究获得国家重点研发计划、国家自然科学基金、云南省重大科技项目、云南省西南联合研究生院科技项目、北京市科委、深圳市医学研究专项资金、深圳市三明项目-病媒生物预防与研究项目、新基石科学基金和浙江大学上海高等研究院繁星科学基金等项目的支持。
文章链接:
DOI: 10.1038/s41563-025-02284-w