近日,清华大学基础医学院郭晓欢团队在Cell Press细胞出版社旗下期刊Trends in Immunology发表了题为“Group 3 Innate Lymphoid Cells: Guardians of Intestinal Homeostasis”的综述。该文章系统总结了3型天然淋巴样细胞在维持肠道稳态和调控肠道疾病中的核心作用。

肠道稳态对于人体健康至关重要,其维持依赖于肠道上皮细胞、肠道微生物群和免疫系统之间复杂而精细的相互作用。在所有免疫细胞中,主要定植于肠道的3型天然淋巴样细胞(ILC3s)在维持肠道稳态方面发挥着关键作用。通过表达IL-22和主要组织相容性复合体Ⅱ类分子(MHCII)等多种效应分子,ILC3s协调肠道上皮反应,调节固有免疫和适应性免疫,促进宿主与微生物群的共生关系、维持免疫耐受并提供抗病原体保护。本综述系统总结了目前学术界对ILC3s在肠道稳态中功能的认识,强调了它们与微生物群及其他细胞类型的相互作用,并概述了ILC3s功能异常如何参与肠道疾病的发生发展。
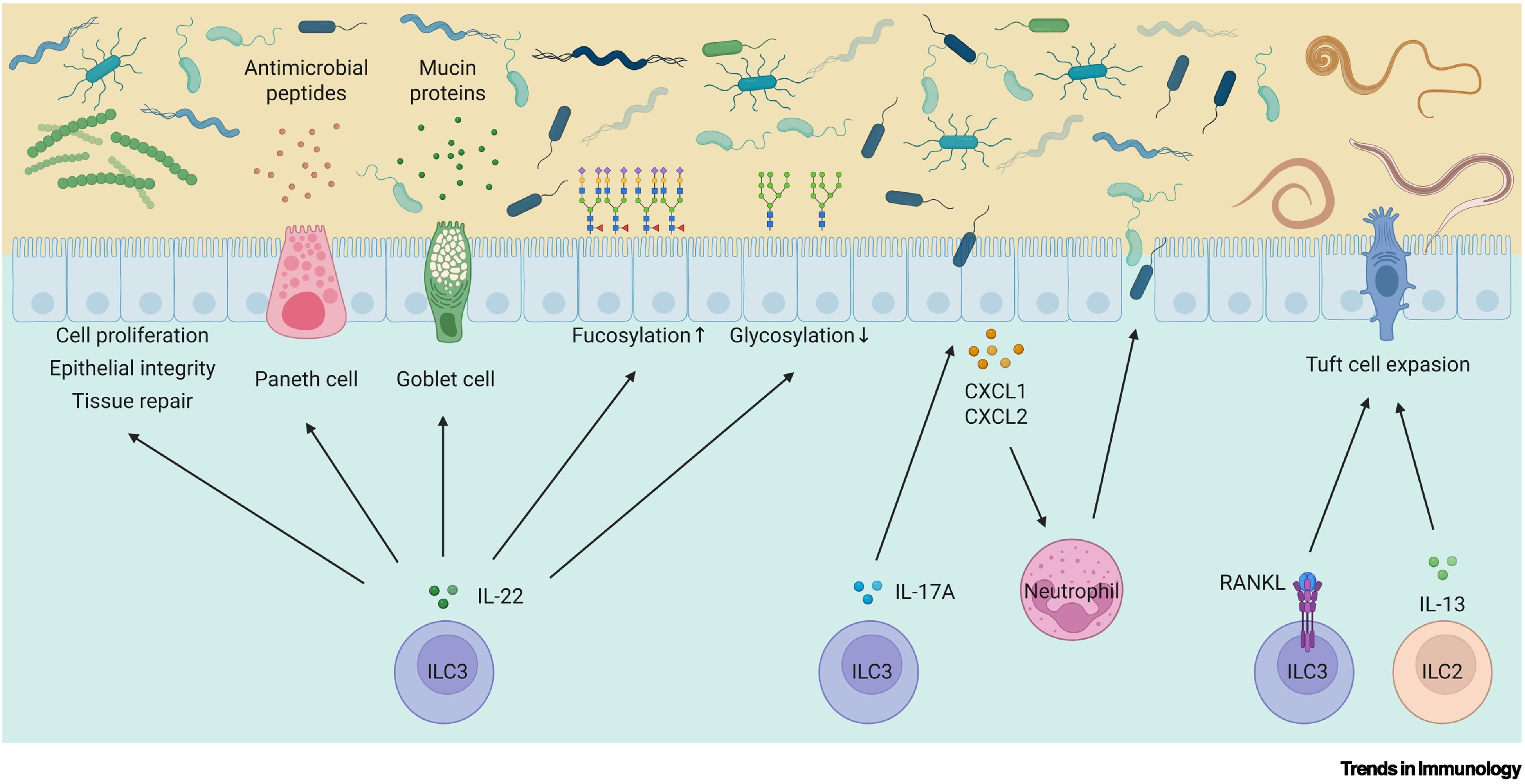
ILC3s不仅是众多肠道组织(肠系膜淋巴结、派氏小结和孤立淋巴滤泡等)发育所必需的细胞,更通过细胞因子分泌、抗原呈递和细胞间接触等多种方式,广泛参与上皮屏障维护。在维护上皮屏障过程中,ILC3s来源的IL-22发挥了至关重要的作用。IL-22能够直接作用于上皮细胞,调控干细胞的增殖与分化,维持上皮完整性并促进上皮修复。IL-22既可以刺激潘氏细胞分泌抗菌肽,也可以刺激杯状细胞分泌粘液素,抗菌肽和粘液素可以帮助机体抵御有害微生物对肠道的破坏。ILC3s通过IL-22依赖的方式精细调控肠道上皮细胞的糖基化修饰,如岩藻糖基化和半乳糖基化,从而重新塑造肠道菌群生态并影响宿主对病原体的易感性。此外,ILC3s可以通过IL-17A刺激肠上皮产生趋化因子CXCL1、CXCL2招募中性粒细胞,进而清除入侵肠道的有害微生物。ILC3s表达的RANKL还可促进由ILC2–簇细胞介导的抗寄生虫免疫反应。
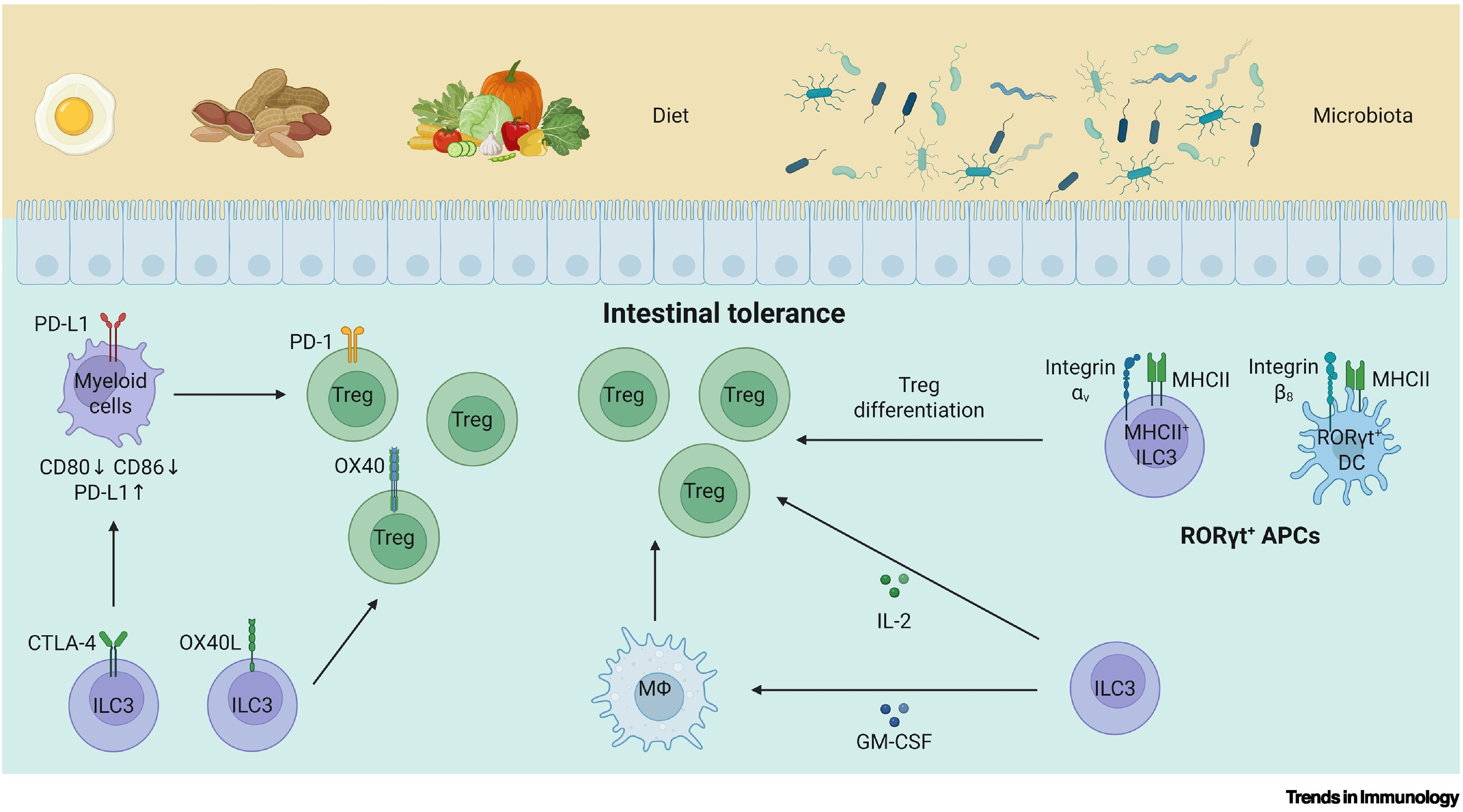
ILC3s在调控肠道免疫耐受方面,同样发挥着复杂而精密的调节作用。肠道是人和小鼠消化吸收食物的主要器官,有大量的微生物定植于此。肠道长期暴露于大量的食物抗原和微生物抗原之下,是机体重要的免疫器官。在建立对食物抗原和微生物抗原的免疫耐受过程中,ILC3s发挥着关键作用。一方面,ILC3s表面的各类共刺激分子可以直接通过细胞间相互作用调控T细胞的功能;另一方面,ILC3s可以通过诱导调节性T细胞(Treg)促进肠道免疫耐受。通过产生GM-CSF和IL-2等细胞因子,ILC3可以调节Treg的扩增与稳态,这对于维持肠道免疫耐受至关重要。
近期,多篇文章报道了一群特殊的抗原呈递细胞——表达RORγt的抗原呈递细胞(RORγt+ APCs)的特殊作用。这群抗原呈递细胞具有显著的异质性,包含MHCII+ ILC3s、RORγt+ DCs等不同种类的细胞。多项研究显示,RORγt+ APCs在诱导针对共生菌和食物抗原的特异性Treg分化中起着关键作用,对于建立外周免疫耐受,尤其是肠道耐受至关重要。当前,针对不同的RORγt+ APCs的来源、功能以及关系尚不清楚,仍有待研究。
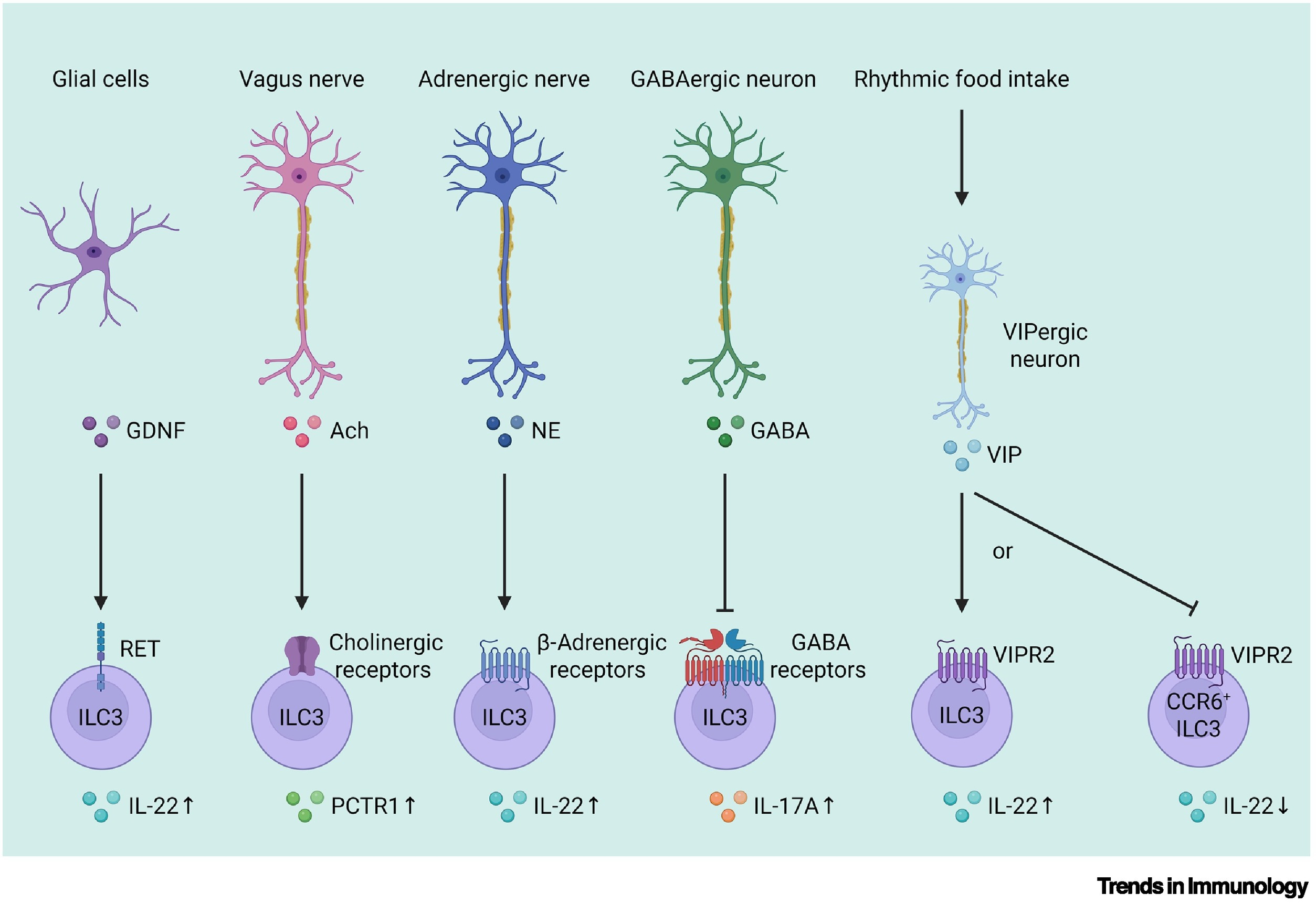
近年来,有大量研究聚焦于免疫系统与神经系统之间的相互作用,ILC3s同样可受神经系统的调节。肠道中的ILC3s表达多种神经信号受体,能够迅速响应肠道神经元的刺激。例如,神经胶质细胞可以分泌胶质细胞源性神经营养因子(GDNF),促进ILC3s分泌IL-22;迷走神经可以分泌乙酰胆碱(Ach),促进ILC3s分泌组织再生相关保护素1(PCTR1);交感神经可以分泌去甲肾上腺素,促进ILC3s分泌IL-22。ILC3s与神经系统之间的密切关系进一步揭示了其在肠道免疫中的核心作用。
ILC3s的功能异常与多种肠道疾病的发生发展密切相关。在炎症性肠病(IBD)中,患者肠道内常呈现ILC3s数量减少或功能受损的特征,具体表现为IL-22、IL-2等细胞因子水平下降及MHCII表达降低;与之相伴的是ILC1s或具有IFN-γ分泌能力的“ex-ILC3”样细胞群体的扩增。值得注意的是,IL-22在不同的IBD病人以及IBD的不同阶段中可能发挥完全不同的功能:早期IL-22可发挥保护效应,但在特定条件下也可能参与后期的炎症发展。
在结直肠癌(CRC)患者中,ILC3s的功能同样呈现出复杂多面性。ILC3s来源的IL-22在疾病早期有助于维持上皮完整性并促进上皮细胞的DNA损伤修复,然而其持续激活则可能推动上皮增殖、化疗抵抗及肿瘤生长。此外,ILC3s通过MHCII分子参与维持有益的抗肿瘤菌群稳态;然而,MHCII表达缺失则与更具侵袭性的结直肠癌表型及对抗PD-1治疗不敏感相关。
从ILC3s最初被发现至今,已有大量的研究成果明确证实ILC3s是肠道免疫稳态的核心协调者。这类具有组织驻留性的特殊淋巴细胞能够整合多种环境信号,包括共生微生物、膳食代谢产物、细胞因子网络及细胞间相互作用,从而精细调控黏膜免疫。通过细胞因子分泌、抗原呈递和直接细胞接触信号传递,ILC3s维持着耐受与炎症、上皮完整与修复、宿主防御与组织保护之间的微妙平衡。尽管如此,我们对ILC3s的调控信号、内在发育与功能程序的理解仍未完善,许多基础机制尚待完整阐明,其参与人类疾病的作用仍待深入探究。在未来,我们期待更多的原创性研究能为此提供关键证据,揭开ILC3s的神秘面纱。
论文作者介绍
清华大学基础医学院郭晓欢副教授为本文的通讯作者,清华大学基础医学院博士后郝嘉成为本文的第一作者。课题组长期聚焦于以ILC3s为核心的黏膜免疫调控研究,近年内陆续解析了ILC3s维持黏膜免疫耐受与菌群稳态的多种新机制(Nat Microbiol 2025,J Exp Med 2024等),发现了ILC3s等在黏膜感染、炎症、肿瘤等疾病中发挥的关键作用与调控机制(Sci Immunol 2025, Cell Metab 2021, Nat Commun 2024, Mucosal Immunol 2024, J Allergy Clin Immunol 2022等),推动了相关领域的发展,被国际黏膜免疫学学会会刊遴选为“Emerging leader in mucosal immunology”。本课题获得了国家自然科学基金、国家重点研发计划、山西医科大学-清华大学前沿医学协同创新中心等项目的支持。
原文链接
https://www.cell.com/trends/immunology/fulltext/S1471-4906(25)00307-2
短期免费全文链接
https://authors.elsevier.com/a/1mIUp5Eb0R-bv0