近日,清华大学基础医学院潘登团队携手合作者取得重要科研进展,不仅揭示了免疫突触介导的肿瘤免疫逃逸机制,还提出了靶向治疗新策略,并且联合开发了肿瘤免疫靶点鉴定平台 ICRAFT,深入解析了 A20 抗肿瘤机制。相关研究成果分别于 2 月 25 日在 Cell Reports Medicine 杂志发表了题为 “Potentiating anti - tumor immunity by re - engaging immune synapse molecules” 的论文,以及于 2 月 28 日在 Immunity 杂志发表了题为 “Integrated computational analysis identifies therapeutic targets with dual action in cancer cells and T cells” 的论文。
1. 揭示免疫突触介导的肿瘤免疫逃逸机制及靶向治疗新策略
在抗肿瘤免疫反应中,细胞毒性T细胞(CTL)和自然杀伤细胞(NK细胞)是核心的“免疫战士”。T细胞通过其表面的T细胞受体(TCR)特异性识别肿瘤细胞表面的抗原肽-MHC复合物,并在共刺激分子的激活或共抑制分子的调控下发挥抗肿瘤作用;而NK细胞则通过表面的共刺激和共抑制分子直接与肿瘤细胞上的配体结合,调节其杀伤功能。免疫突触(IS)的形成是免疫细胞与肿瘤细胞“对决”的关键环节,它通过粘附功能增强肿瘤与免疫细胞的相互作用,并利用共刺激分子促进免疫细胞的活化。然而,肿瘤细胞常常通过多种机制逃避免疫系统的攻击,例如抗原呈递途径的下调,以及免疫抑制分子如PD-L1和SERPINB9的上调等。但肿瘤细胞如何通过免疫突触实现免疫逃逸,这一机制仍不明确。

发表于Cell Reports Medicine杂志的研究论文发现,肿瘤通过抑制免疫突触/共刺激分子ICAM-1的表达介导了肿瘤的免疫逃逸。在分子机制方面,通过CRISPR全基因库筛发现,肿瘤ICAM-1的表达受到UHRF1/DNMT1所涉及的DNA甲基化途径的负调控。为应对肿瘤通过下调ICAM-1表达实现的免疫逃逸,研究团队设计了一种名为“LFA-1接合器”的双特异性抗体。该抗体旨在同时靶向肿瘤细胞的肿瘤相关抗原(TAA)和T细胞的LFA-1分子。实验结果显示,LFA-1接合器能够在肿瘤细胞和T细胞表面重塑ICAM-1/LFA-1信号轴,显著增强了T细胞的抗肿瘤功能。此外,该接合器还可重塑肿瘤免疫微环境,特异性激活肿瘤内浸润T细胞的分化和功能,并可协同抗PD-1治疗进一步提升机体的抗肿瘤免疫能力。
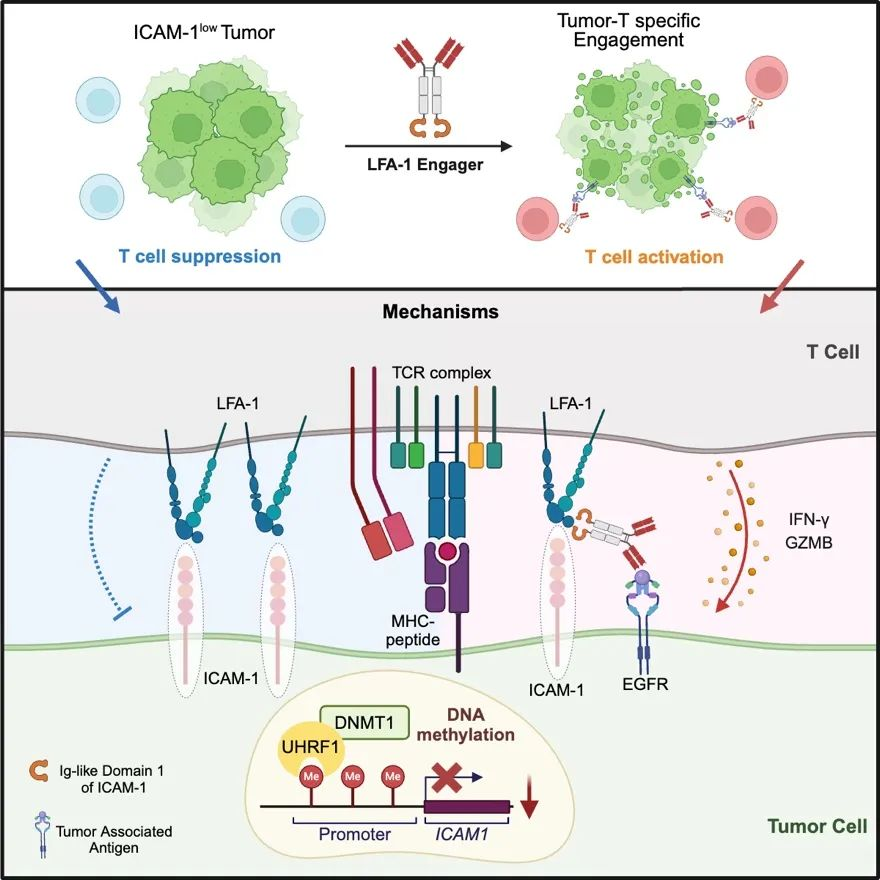
本研究不仅揭示了免疫突触介导的免疫逃逸机制及其关键分子ICAM-1的调控方式,还为基于ICAM-1的肿瘤免疫治疗提供了新的思路和重要的实验依据。通过重新激活免疫突触相关信号,LFA-1接合器有望为肿瘤免疫治疗开辟新的道路。未来,随着相关研究的不断深入,这种新型抗体疗法有望走向临床,为肿瘤患者带来更有效的治疗选择。
清华大学基础医学院博士生周心迪为本文第一作者。清华大学基础医学院潘登和北京大学定量生物学中心曾泽贤为本文的共同通讯作者。潘登和曾泽贤均为清华-北大生命联合中心PI。清华大学基础医学院傅阳心教授为双特异性抗体的研发提供了重要的技术支持。
2. 合作开发肿瘤免疫靶点鉴定平台ICRAFT以及解析A20抗肿瘤机制
近年来,免疫治疗(如PD-1/PD-L1免疫检查点抑制剂)在癌症治疗中取得了突破性进展,为许多患者带来了前所未有的生存获益。然而,尽管部分患者在治疗初期表现出良好反应,但大量临床数据显示,并非所有患者都能从中受益,且部分患者在接受治疗后会产生耐药性。更重要的是,许多肿瘤治疗策略往往只关注如何杀伤癌细胞,却忽略了其对免疫系统的影响,导致一些治疗在削弱肿瘤的同时,也损害了机体的抗癌免疫能力。此外,大量靶点发现研究主要基于转录组数据的相关性分析,难以直接揭示基因对肿瘤微环境和免疫细胞的功能影响,这使得免疫治疗靶点的筛选尤为困难。

2025年2月28日发表于Immunity杂志的研究论文中,研究者开发了ICRAFT平台,该平台整合了来自90项研究的558个CRISPR筛选数据集、200万单细胞RNA-Seq数据和943个免疫治疗临床样本的RNA-Seq数据,可以系统性挖掘在肿瘤细胞和免疫细胞中具有免疫调节功能的关键基因。ICRAFT作为一个完全开源的在线分析平台,不仅提供可交互式数据分析,还为科学社区提供了高质量、标准化的数据资源,有利于加速肿瘤免疫研究和治疗策略的开发。
团队重点解析并实验验证了TNFAIP3(A20)基因的功能,并首次揭示了其在肿瘤微环境中的双重作用。在肿瘤细胞中,TNFAIP3缺失可激活TNF诱导的细胞凋亡通路,并上调NF-κB信号通路,增强趋化因子表达,促进T细胞浸润,使肿瘤细胞对免疫杀伤更加敏感。而在T细胞中,TNFAIP3的失活能够增强CD8+ T细胞的抗肿瘤能力,使其在肿瘤环境中更具杀伤力。换言之,靶向TNFAIP3不仅能够削弱肿瘤细胞的免疫逃逸能力,还能同时提升T细胞的抗癌效力,展现出极大的临床应用潜力。
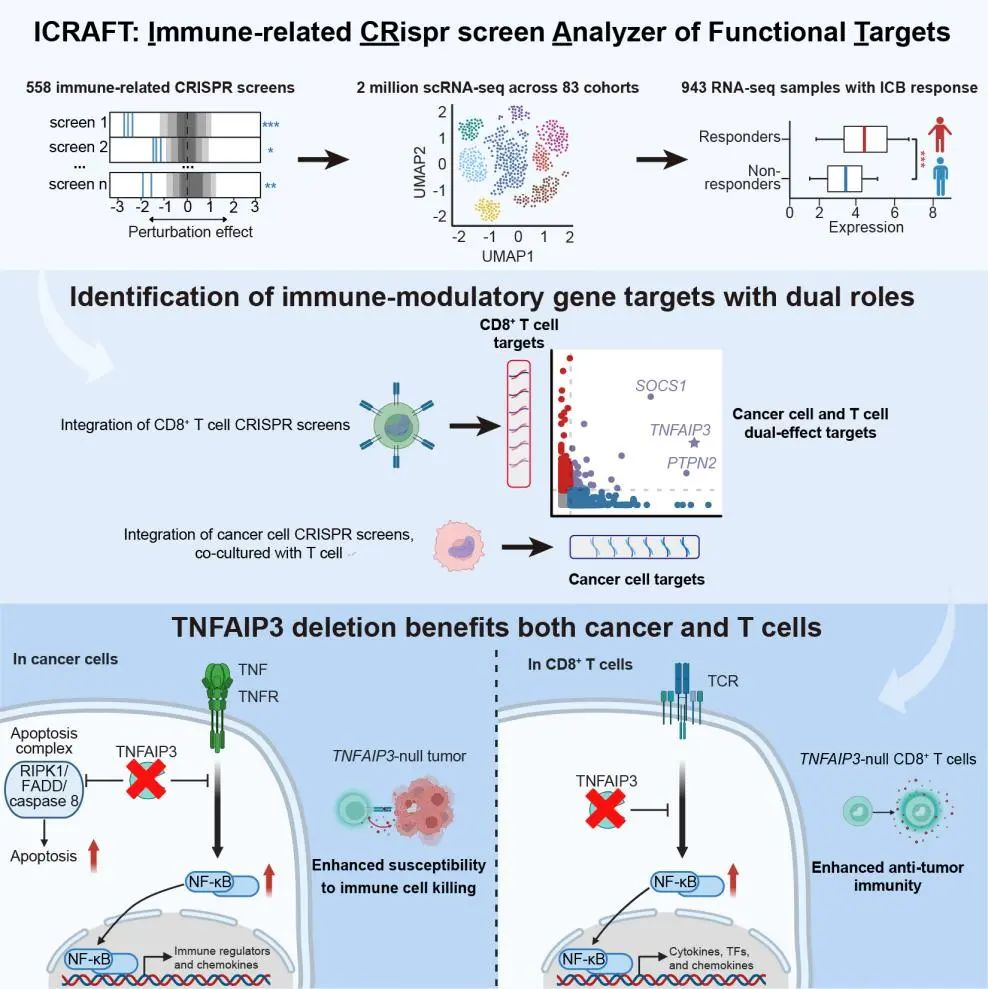
北京大学定量生物学中心博士生罗策,北京大学-清华大学生命科学联合中心博士后张瑞和博士生郭睿为该论文的共同第一作者。北京大学定量生物学中心曾泽贤、清华大学基础医学院潘登、北京大学人民医院高志冬为本文的共同通讯作者。ICRAFT作为开放平台将为科学家提供更多机会探索新的免疫功能调节靶点。
原文链接:
1.https://www.sciencedirect.com/science/article/pii/S2666379125000485
2.https://authors.elsevier.com/a/1khAA_OR%7Eyin9e