近年来,以PD-1/PD-L1(程序性死亡受体-1/ 程序性死亡配体-1)抗体为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)在肿瘤治疗领域中取得了里程碑式的突破。然而,ICI疗法在不同肿瘤病人中的效果差异很大,绝大部分的患者无法产生有效应答,产生应答的患者也很难长期获益。如何克服ICI疗法的局限性成为了当前肿瘤免疫研究领域的热点问题。研究表明,肿瘤细胞内在的免疫逃逸信号和具有免疫抑制性的肿瘤微环境都是阻碍ICI疗法的关键因素。因此,要充分发挥ICI疗法的临床潜力,建立一个能同时抑制肿瘤细胞内在免疫逃逸信号和降低肿瘤免疫微环境抑制性的新策略可能是一个重要思考方向。
2025年3月12日,清华大学基础医学院郑撼球团队在Nature Cancer期刊上发表了题为“Targeting Both Death and Paracaspase Domains of MALT1 with Antisense Oligonucleotides Overcomes Resistance to Immune Checkpoint Inhibitors”的研究论文。在本篇文章中,研究团队发现黏膜相关淋巴样组织淋巴瘤易位蛋白(Mucosa-associated lymphoid tissue lymphoma translocation protein 1, MALT1)通过双重机制促进肿瘤免疫逃避:一、MALT1通过蛋白酶活性上调PD-L1的表达;二、MALT1通过死亡结构域促进肿瘤相关巨噬细胞的M2型极化以增强肿瘤微环境的免疫抑制性。同时,研究人员还通过反义寡核苷酸(antisense oligonucleotide, ASO)靶向MALT1,实现了对PD-L1的抑制和肿瘤微环境的重塑,克服了肿瘤对ICI疗法的抵抗,充分体现了靶向MALT1在临床应用的治疗前景。

首先,研究人员通过肿瘤细胞与CD8 T细胞共培养体系下的CRISPR-a筛选,鉴定出MALT1是导致肿瘤细胞抵抗CD8 T细胞杀伤的内在免疫逃逸信号。随后,通过小鼠肿瘤模型分析和单细胞测序技术等,研究人员发现MALT1还能介导肿瘤细胞促进巨噬细胞的增殖和M2型极化,从而增强肿瘤微环境的免疫抑制性。
在机制上,MALT1一方面利用蛋白酶活性切割ROQUIN1和ROQUIN2,阻止它们降解PD-L1的mRNA,从而上调肿瘤细胞PD-L1的表达,导致肿瘤细胞抵抗CD8 T细胞杀伤。另一方面,MALT1通过其死亡结构域结合BCL10,参与肿瘤细胞中CARD-BCL10-MALT1 (CBM)复合物的形成,激活NF-κB信号通路,促进肿瘤细胞分泌CSF1、PGE2、CXCL1等因子。这些因子的分泌能促进肿瘤相关巨噬细胞的增殖,并使它们极化为M2型巨噬细胞,加剧肿瘤微环境的免疫抑制性,促进肿瘤免疫逃逸。
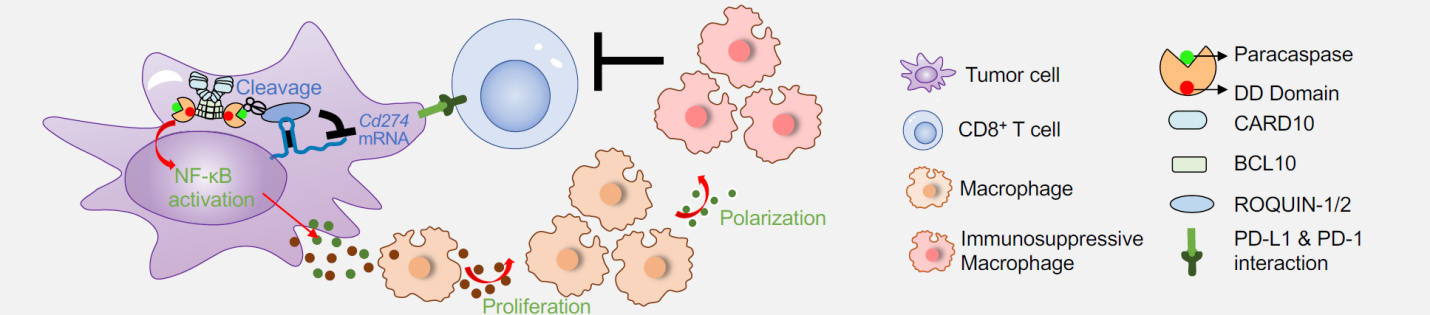
MALT1工作模式图
由于MALT1通过两种不同的机制促进肿瘤免疫逃逸,靶向MALT1必须同时抑制其蛋白酶活性和死亡结构域功能。然而,现有的MALT1抑制剂仅能抑制蛋白酶活性,并不能限制其死亡结构域功能。因此,研究人员使用ASO技术靶向MALT1,在病人肿瘤样本和临床前小鼠肿瘤模型中成功抑制了MALT1的双重作用。临床前小鼠肿瘤模型研究还表明,通过ASO靶向MALT1能显著减缓肿瘤的生长,提高ICI疗法的响应度和疗效。
清华大学基础医学院、分子肿瘤学全国重点实验室、山西医科大学-清华大学医学院前沿医学协同创新中心的郑撼球研究员为论文的通讯作者。清华大学基础医学院已毕业(2019级)的陶榆玮博士为论文的第一作者。清华大学基础医学院林欣教授团队和蓝勋副教授团队、清华大学化学系喻国灿助理教授团队、中国医学科学院肿瘤医院周海涛教授团队和刘嘉琦副主任医师团队为该研究提供了技术指导、数据分析、ASO系统递送和病人样本收集等帮助。本研究得到了国家自然科学基金项目、国家重点研发计划等项目基金的支持。
原文链接:
https://www.nature.com/articles/s43018-025-00930-5