在高等真核生物中,同一个基因组可以“读出”数百种甚至上千种不同的细胞类型。基因通过转录生成RNA,RNA既指导蛋白质合成,也影响染色质和细胞核结构。虽然编码蛋白质的mRNA只占基因组约2%,但超过98%的基因组区域并不编码蛋白质,却可能被转录生成非编码RNA(ncRNA)。这些非编码RNA通常水平低、随机性强、半衰期短,大多停留在细胞核内。理解这些新生RNA的产生和调控,对于揭示基因组如何驱动多样化的细胞命运至关重要。
2025年9月26日,清华大学医学院沈晓骅课题组在《细胞》(Cell)在线发表题为 “单细胞新生转录揭示稀疏的基因组使用与可塑性”( Single-cell nascent transcription reveals sparse genome usage and plasticity)的论文。研究团队开发了单细胞新生转录组测序新方法 scFLUENT-seq,能够高灵敏、全基因组地捕获新生转录本,并更好地保留RNA起始信息。
研究显示,即便在转录最活跃的小鼠胚胎干细胞中,任一时刻被转录的基因组比例也仅约 3%,但仍比终末分化的脾脏淋巴细胞高出 50倍以上。而合并所有细胞,新生转录几乎覆盖了基因组的 80%。这一差异表明:单细胞转录极其稀疏、随机且异质,而群体分析往往掩盖了这种细胞间差异。并且,非编码区域的转录比蛋白编码基因更具随机性;异染色质区的远端转录单元虽然稀疏,但显示出依赖染色质环境的调控模式。
研究还比较了蛋白编码基因和非编码转录的合成与降解速率,发现群体层面呈现耦合关系,但在单细胞中并非简单线性对应,反而非编码转录展现出更强的线性规律。提出了 “新生转录多样性” 概念,用于识别瞬时、不稳定的细胞状态:这些细胞在稳态转录组中差异不明显,但在新生转录层面会同时转录更多蛋白编码基因和非编码单元,反映出细胞处于动态过渡阶段,展现出更强的命运可塑性(plasticity)。
本研究不仅在技术上实现了单细胞新生转录的精准测量,也在理论上回应了两个核心问题:非编码“暗物质”的转录活动以及生命调控的概率性本质。通过定量揭示新生转录的稀疏性和异质性,研究突破了稳态转录组的局限,为打破既有生物学范式、重塑基因调控和细胞命运的理解框架提供了新视角。
本研究第一作者为清华大学基础医学院2021级博士研究生马绍骞;共同通讯作者为基础医学院沈晓骅教授与马绍骞。研究工作获得了国家自然科学基金委项目及清华大学医学院、生命联合中心、北京生物结构前沿研究中心、和膜生物学全国重点实验室的资助。
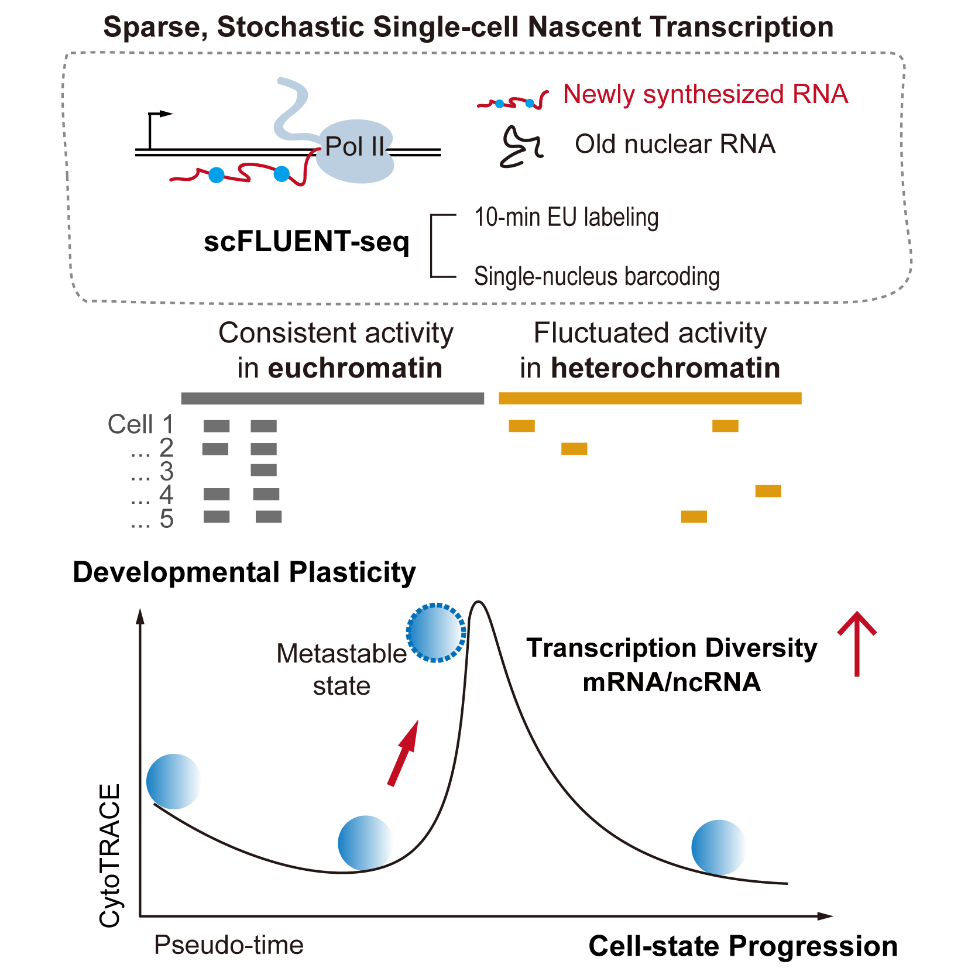
图. 单细胞新生转录组检测和转录的异质性与可塑性
论文链接:
https://doi.org/10.1016/j.cell.2025.09.003
实验室简介
沈晓骅实验室研究非编码基因组转录、染色质折叠以及细胞核结构和功能的基本规律,探索微观概率下的调控机制和生命的物理与数学基础。团队通过细胞核物理建模,研究遗传信息解读的物理特性,揭示DNA、RNA、蛋白质到细胞表型的生命信息流及其程序化规律,为理解基因组功能和细胞命运提供新的理论框架。欢迎具有数理和工程背景的学生和博士关注和加入我们(xshenlab.com),共同探索生命科学的定量与本质问题。