流感病毒是导致全球季节性流行感冒的重要病原体,每年都会引发数百万严重感染病例。它是一种分节段的负链RNA病毒,其基因组由8条负链RNA片段组成,每条RNA的3’和5’末端都要与RNA聚合酶(FluPol,由PA、PB1和PB2三个亚基组成)以及核蛋白(NP)结合,共同组装成核糖核蛋白复合物(RNP)。RNP既是病毒复制和转录的基本单元,也是整个病毒生命周期的核心“机器”。 然而,由于RNP本身具有高度的动态性和复杂性为其结构研究带来了重大挑战。虽然此前一些低分辨率的研究已经勾勒出RNP的大致轮廓,但其分子细节依旧是困扰病毒学领域的重大科学难题。mini-vRNP是最小的功能性核糖核蛋白复合物,其中仅包含248个核苷酸,相比天然RNP而言具有更强的结构刚性。在保留基本功能的同时,大幅简化了体系的复杂度,因此成为RNP结构研究的理想模型。但即便如此,目前对mini-vRNP的结构研究仍停留在亚纳米分辨率水平,阻碍了人们对于RNP中聚合酶-核蛋白-RNA之间相互作用的认知。
2025年11月4日,清华大学基础医学院娄智勇教授、饶子和院士团队联合英国牛津大学Ervin Fodor教授团队,在《Nature Communications》发表了题为 “Coupling of polymerase-nucleoprotein-RNA in an influenza virus mini ribonucleoprotein complex” 的研究论文。研究团队利用冷冻电镜单颗粒技术,在近原子分辨率下成功解析了mini-vRNP的结构,首次揭示了聚合酶、核蛋白和RNA三者之间的精细耦合方式,并捕捉到RNP在不同功能状态下的构象变化。这一成果不仅回答了多年来未解的核心科学问题,还为未来开发抗流感新策略提供了潜在靶点。

研究人员首先在哺乳动物细胞中重组并纯化了mini-vRNP并通过荧光观察和qPCR验证其活性与组分。随后经过优化的冷冻电镜数据处理策略克服了样品中的柔性和异质性最终得到了mini-vRNP的两种主要构象。 一种是聚合酶嵌入NP-RNA环的中央,被命名为“State-In”,其整体分辨率2.89 Å,聚合酶分辨率达到2.97 Å;另一种则是聚合酶旋转到环的外缘,称为“State-Out”,其整体分辨率5.54 Å,聚合酶分辨率达到3.62 Å。在State-In中,聚合酶与宿主RNA聚合酶II结合所需的界面被NP环遮挡,呈现一种静息状态;而在State-Out中,这些界面完全暴露,聚合酶得以与宿主因子结合,从而启动病毒的转录和复制。因此研究人员推测RNP在病毒上周期中可能通这样的构象变化实现了其静息状态和活性状态动态调控。
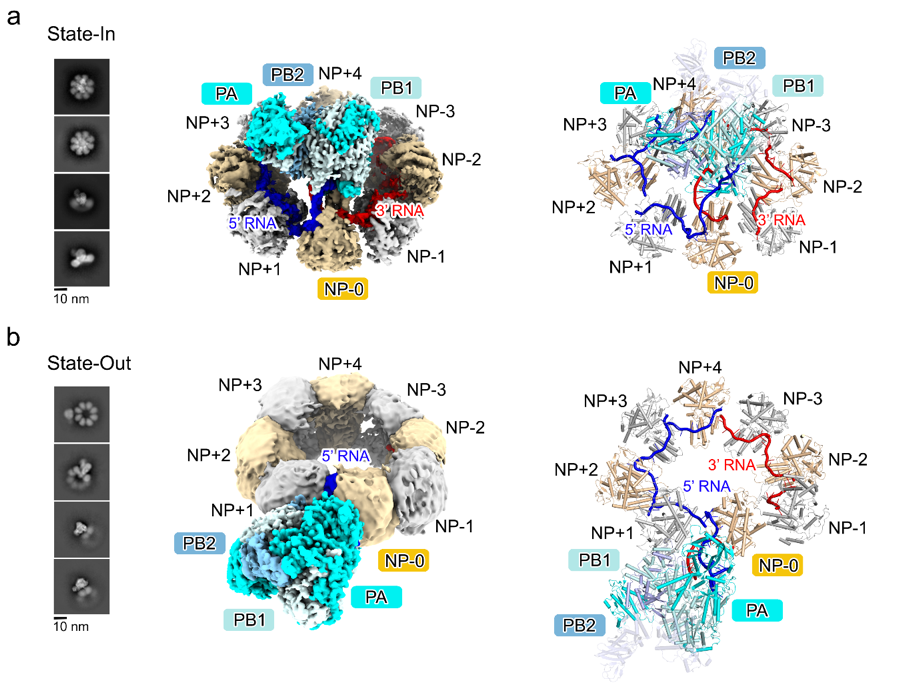
更为重要的是,研究揭示了一个特殊的核蛋白亚基——NP-0。它位于聚合酶邻近的位置,与其他NP相比表现出独特的RNA结合形式。研究发现,NP-0通过其D72-K90区域插入RNA双链的分叉处,将双链RNA劈开为单链,并将其稳定地固定在自身的RNA结合槽中。这一构象不仅保护了RNA的末端结构,防止其降解,同时也为RNP环状结构的稳定性提供了支撑。与此同时,NP-0通过关键残基R208,S245,N247与聚合酶PA亚基和RNA之间形成复杂的相互作用网络。为了确定这些相互作用在病毒复制过程中的作用。研究人员们分别突变了NP和PA亚基上参与相互作用的氨基酸并通过复制子体系测定了突变体的转录复制活性,结果表明NP-0中的R208对于病毒的转录复制活性至关重要。
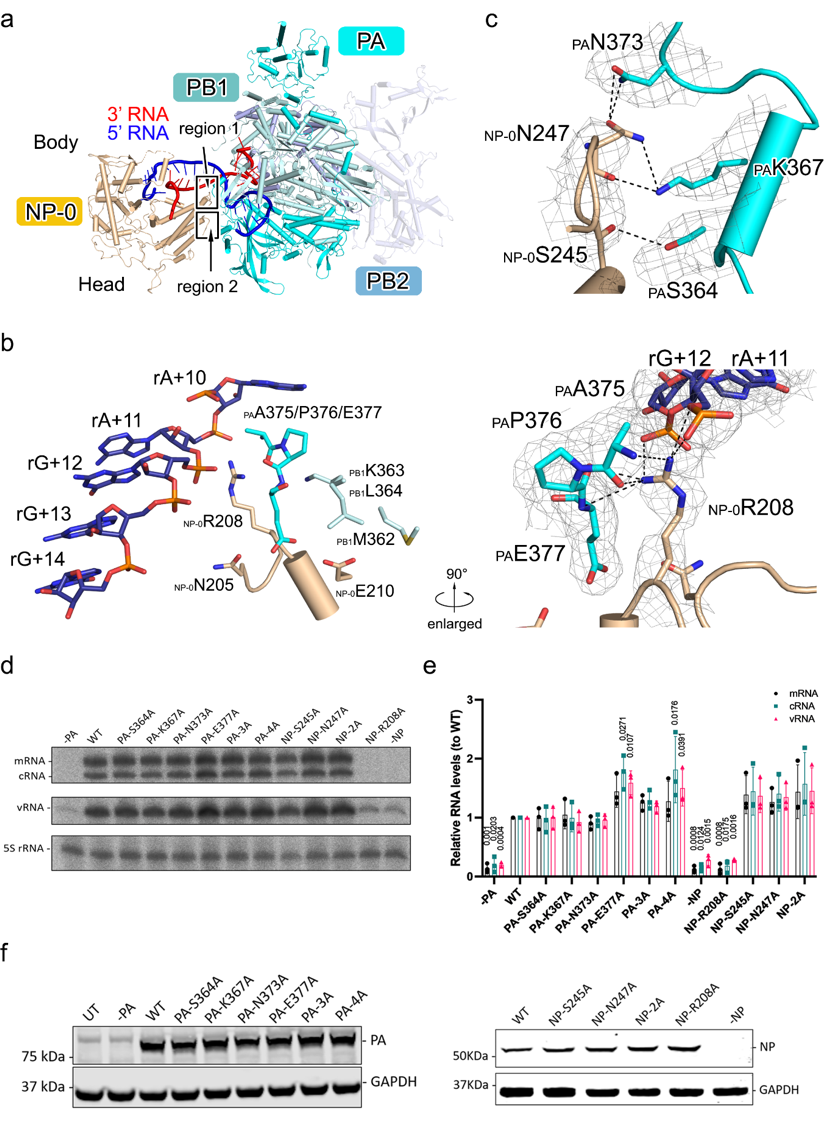
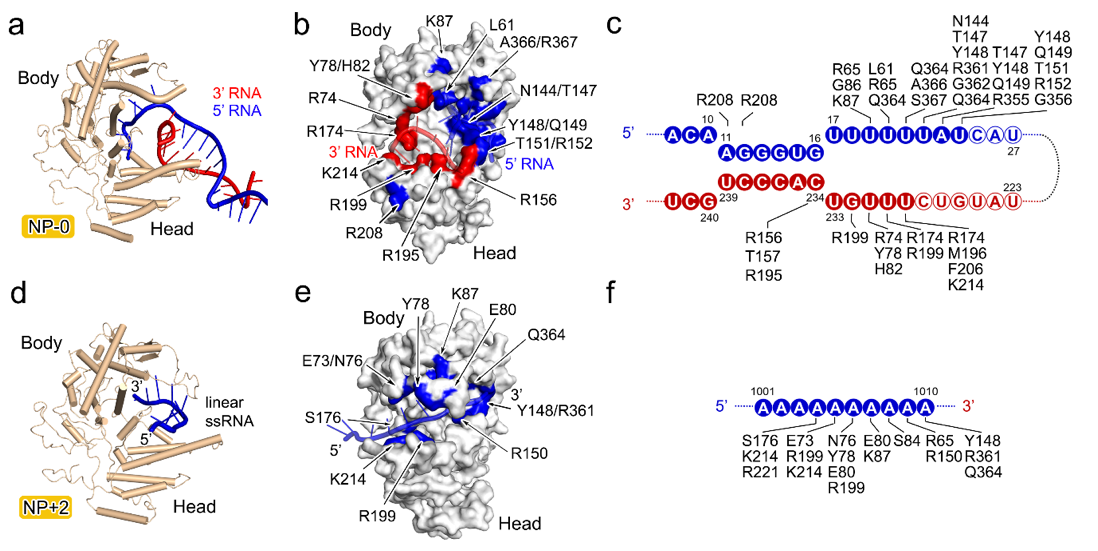
此外,研究团队还对比了NP-0与其他常规位置NP的RNA结合方式,揭示了两种模式的差异。在NP-0中,RNA以分叉的形式结合,表现出独特的双链劈开与稳定功能;而在其他位置的NP中,RNA以线性片段结合,每个NP大约容纳10个核苷酸,多个NP的结合槽首尾相连,形成一条连续的RNA保护路径。这一连续排列不仅牢固地包裹了病毒RNA,也最大限度地避免了外源核酸酶的攻击。。值得注意的是,许多被证实对病毒增殖至关重要的氨基酸残基,正好分布在这些RNA结合槽之中,这为开发靶向NP-RNA结合界面的新型抗流感药物提供了重要启示。
这一系列发现使人们第一次能够在分子层面直观地理解流感病毒中聚合酶-核蛋白-RNA之间偶联的分子机制。同时基于结构信息提出了流感病毒RNP的工作模型:当聚合酶被NP-RNA环遮挡时,RNP保持静息;而当聚合酶转向NP-RNA环的外缘时,它便进入工作状态,启动RNA合成。RNP通过这样“旋转开关”式的构象变化,在静息和活性之间完成精准调控。这种偶联和动态机制不仅深化了人们对病毒生命周期的理解,也为未来寻找阻断病毒复制的策略提供了新思路。
清华大学基础医学院娄智勇教授、饶子和院士与牛津大学Ervin Fodor教授为该论文的共同通讯作者。这项工作也是继2009年《Nature》解析流感病毒聚合酶亚基PAN的晶体结构之后,饶子和院士团队与Ervin Fodor教授团队的又一次强强联手。清华大学基础医学院博士后康惠玲、助理研究员杨云翔、博士生刘奕潇、已毕业博士生李明宇以及中国科学技术大学生命科学学院博士生张乐今为论文共同第一作者;来自上海科技大学、广州国家实验室、河北医科大学第四医院、华中科技大学、昆士兰大学和南开大学的研究者们共同参与完成了这项工作。
文章链接
https://www.nature.com/articles/s41467-025-64741-z